2019年10月24日,维多利亚老品牌vic3308校友、英国曼彻斯特大学Nigel S. Scrutton课题组的张绍伟在Nature杂志在线发表了题为“Structural basis for enzymatic photocatalysis in chlorophyll biosynthesis”的研究论文,解析了原叶绿素酸酯氧化还原酶A的结构,揭示了光催化叶绿素生成的分子机制。

原叶绿素酸酯氧化还原酶(POR)是催化叶绿素生物合成中的光依赖性步骤,这对光合作用至关重要,并最终对地球上的所有生命至关重要。POR是三种已知的光依赖性酶之一,它催化光敏剂和底物原叶绿素的还原,形成叶绿素。尽管其生物学重要性,但是POR光催化的结构基础仍然未知。
该研究解析了来自蓝藻中游离形式及与烟酰胺辅酶复合的POR的晶体结构。研究表明,protochlorophyllide–NADPH–POR三元复合物的结构模型确定了POR活性位点中的多种相互作用,这对于原叶绿素内酯protochlorophyllide的结合及光敏化和光化学转化为叶绿素很重要。该研究证明了使用POR变体和原叶绿素类似物进行实验时,活性位点结构和原叶绿素结构在驱动POR光化学中的重要性。这些研究揭示了POR活性位点如何通过从NADPH进行的局部氢化物转移和沿结构定义的质子转移途径的远距离质子转移促进光驱动的原叶绿素还原的分子机制。
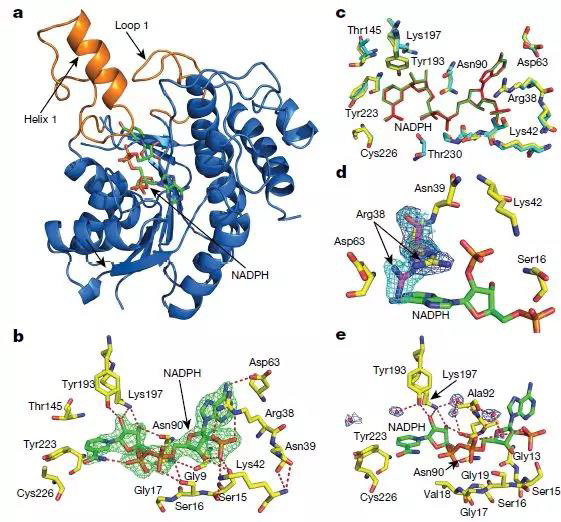
光依赖性POR的晶体结构
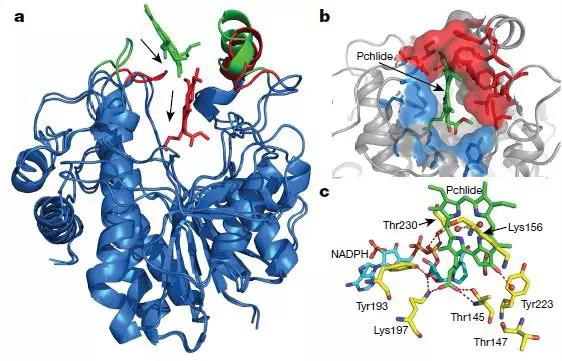
POR-Plide-NADPH三元复合物的结构模型
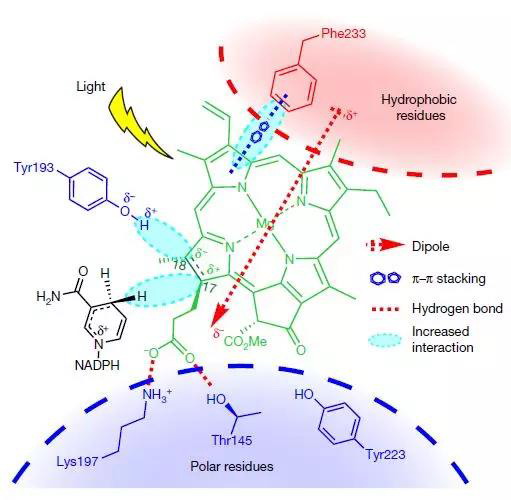
POR中光依赖反应化学的结构基础
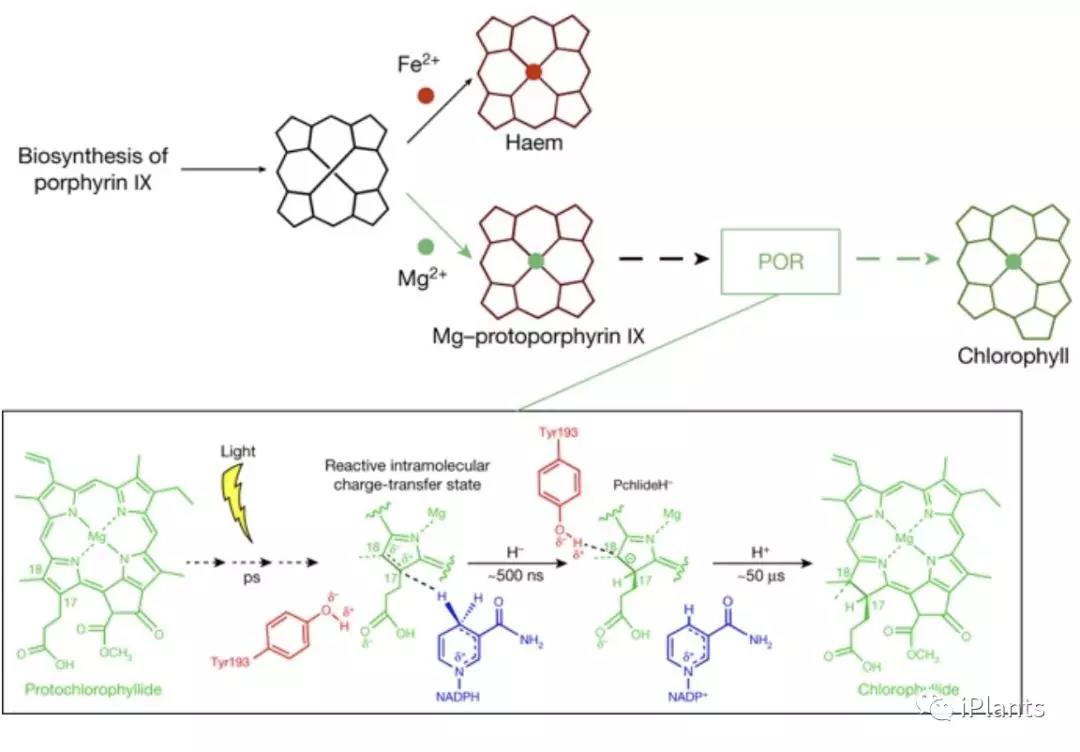
在叶绿素(Chl)的合成过程中,从谷氨酰-tRNA(Glu-tRNA)开始到Chl b的合成结束为止一共包括16步,共由20多个基因编码的16种酶完成。其中光驱动的原叶绿素酸脂Pchlide的C17=C18双键合成生成叶绿素酸酯-a (叶绿素-a的直接前体)。该反应由POR酶催化,是叶绿素生物合成途径中的关键调控步骤。该催化反应涉及Pchlide和蛋白质之间的激发态相互作用,这导致C17=C18双键合成。
张绍伟,维多利亚老品牌vic33082010级生物技术专业本科生、2013级生化与分子生物学专业硕士研究生,师从刘子铎教授。2016年研究生毕业后出国留学,在英国曼彻斯特大学攻读博士学位。
论文链接:https://www.nature.com/articles/s41586-019-1685-2